MoCRA: votre guide de démarrage et ses impacts sur votre entreprise de cosmétiques
MoCRA: votre guide de démarrage et ses impacts sur votre entreprise de cosmétiques
MoCRA: votre guide de démarrage et ses impacts sur votre entreprise de cosmétiques
7 Juil 2023
 John McCurdy | Senior Content Writer, Marketing
John McCurdy | Senior Content Writer, Marketing
Si vous êtes un fabricant, un emballeur ou un distributeur de l'industrie cosmétique sur le marché américain, vous savez probablement que d'importants changements dans les exigences de conformité se profilent à l'horizon avec l'adoption du Modernization of Cosmetics Regulation Act of 2022 (MoCRA). Ce que vous ne savez peut-être pas, c'est ce que la législation signifie exactement pour votre entreprise en termes d'ajustements nécessaires au niveau des opérations et de la stratégie.
Il y a beaucoup à apprendre sur la MoCRA et ses implications pour votre organisation - comme les nouveaux documents à créer et à conserver, les tests à effectuer et certaines exemptions qui peuvent ou non s'appliquer selon votre situation - il est donc préférable de commencer à se préparer dès maintenant. Vous trouverez ci-après une vue d'ensemble et des orientations générales au moment où nous entrons dans une nouvelle ère de réglementation des produits cosmétiques.
Une brève histoire de la MoCRA
Le 29 décembre 2022, le président Joe Biden a signé la loi MoCRA, marquant le début d'un nouveau paradigme en termes de contrôle gouvernemental et de sécurité des produits. Le projet de loi élargit considérablement l'autorité de la Food and Drug Administration (FDA) pour faire respecter les normes et les protocoles sur le marché américain des cosmétiques.
En grande partie le résultat de plus d'une décennie de plaidoyer, la MoCRA comprend un certain nombre de nouvelles exigences pour les fabricants, emballeurs et distributeurs nationaux, ainsi que pour les entreprises internationales qui importent aux États-Unis. En tant que première réforme majeure de la réglementation des cosmétiques depuis le Federal Food, Drug and Cosmetic Act de 1938, de nombreux experts de l'industrie et politiciens ont estimé que cette législation était attendue depuis longtemps.
Auparavant, les produits cosmétiques n'avaient pas à être approuvés par la FDA et les rappels d'articles défectueux n'étaient pas obligatoires, mais la MoCRA change la donne sur ces politiques et implique de nombreux autres changements. Elle marque également la fin du programme d'enregistrement volontaire des produits cosmétiques (VCRP), l'enregistrement des entreprises de cosmétiques étant désormais obligatoire.
Quelles sont les entreprises soumises aux nouvelles exigences de la MoCRA ?
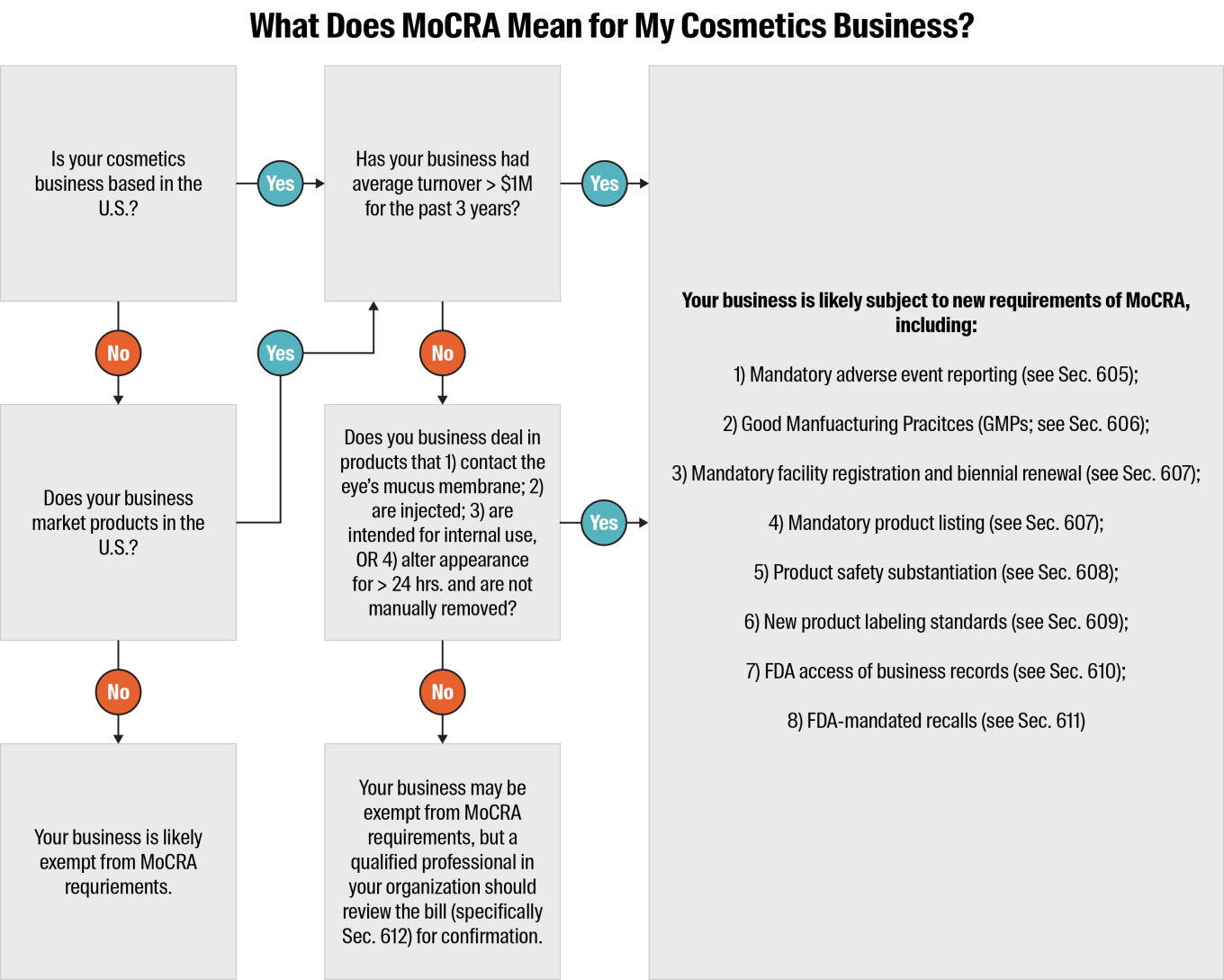
La MoCRA et les nouvelles exigences qu'elle introduit s'appliquent aux fabricants, emballeurs, importateurs et distributeurs de produits cosmétiques finis basés aux États-Unis. Elle s'applique également aux entreprises internationales qui commercialisent leurs produits cosmétiques aux États-Unis.
Certaines exemptions sont prévues pour les petites entreprises dont le chiffre d'affaires annuel moyen est inférieur à 1 million de dollars pour les trois années précédentes. Les exigences d'enregistrement des installations, de listing des produits et de Bonnes Pratiques de Fabrication (BPF) sont levées pour ces organisations, sauf si elles traitent :
Des produits destinés à entrer en contact avec la muqueuse de l'œil
Des produits injectables
Des produits destinés à un usage interne uniquement
Des produits modifiant l'apparence pendant plus de 24 heures et qui ne sont normalement pas enlevés manuellement
Les autres exigences détaillées ci-dessous restent d'application pour ces entreprises.
En quoi consistent les nouvelles exigences ?
Le début de l'application de la loi MoCRA approchant à grands pas, le moment est venu pour vous de vous informer sur les nouvelles exigences et de vous préparer à vous mettre en conformité.
Mais avant d'entrer dans le vif du sujet, vous devez également comprendre la signification de la notion de "personne responsable" telle qu'elle est définie dans la loi. Bien que ce terme implique une seule personne, il s'agit en fait du fabricant, de l'emballeur ou du distributeur dont le nom, l'adresse, le numéro de téléphone et les coordonnées électroniques figurent sur les étiquettes des produits.
Cela dit, il est également souhaitable que vous désigniez un membre du personnel qualifié, joignable à la même adresse et au même numéro de téléphone, qui servira de point de contact principal pour la FDA au sein de votre organisation. Vous devrez soumettre des documents et communiquer avec l'agence plus fréquemment dans le cadre de la MoCRA, il est donc préférable qu'au moins une personne soit familiarisée avec les exigences et les documents correspondants.
Ce concept étant expliqué, examinons les exigences nouvelles ou mises à jour les plus notables :
Déclaration obligatoire des événements indésirables - La personne responsable doit déclarer à la FDA les événements indésirables graves (tels qu'ils sont définis par le projet de loi ; ils comprennent le décès, l'infection, la défiguration et autres) dans les 15 jours suivant l'incident. Ils doivent également fournir des informations médicales actualisées dans l'année qui suit leur déclaration. La FDA a le droit d'accéder aux dossiers d'événements indésirables lors des inspections (voir la section 605 pour plus de détails).
Bonnes pratiques de fabrication (BPF) - Toutes les entreprises de cosmétiques doivent respecter les BPF spécifiques à l'industrie, telles qu'établies par la FDA (voir la section 606 pour plus de détails).
Enregistrement obligatoire des installations auprès de la FDA et renouvellement bisannuel - Toutes les entreprises cosmétiques doivent enregistrer chacune de leurs installations auprès de la FDA et renouveler l'enregistrement tous les deux ans. La FDA a le pouvoir de suspendre l'enregistrement d'une installation si elle détermine que les produits cosmétiques fabriqués ou traités dans cette installation ont une probabilité raisonnable d'avoir des conséquences néfastes graves pour la santé (voir la section 607 pour plus de détails).
Liste de produits obligatoire auprès de la FDA et mises à jour annuelles - La personne responsable doit fournir à la FDA une liste détaillée de tous les produits cosmétiques de son entreprise, y compris les ingrédients, et fournir des mises à jour annuelles (voir la section 607 pour plus de détails).
Justification de la sécurité des produits - Une personne responsable doit tenir des registres démontrant que les produits de son entreprise peuvent être utilisés en toute sécurité (voir la section 608 pour plus de détails).
Normes d'étiquetage des produits - Tous les produits cosmétiques doivent porter une étiquette indiquant l'adresse nationale, le numéro de téléphone et les coordonnées électroniques de l'entreprise, ainsi que la mention de tout parfum allergène contenu dans le produit (voir la section 609 pour plus de détails).
Accès aux dossiers de l'entreprise - Si la FDA a des raisons de penser qu'un produit cosmétique est frelaté ou que son utilisation pourrait avoir des conséquences néfastes graves pour la santé, l'agence a le droit d'accéder aux dossiers de l'entreprise associés à ce produit et de les copier (voir Sec. 610 pour plus de détails).
Pouvoir de rappel obligatoire - Si la FDA détermine qu'un produit cosmétique est falsifié, mal étiqueté ou qu'il pourrait avoir des conséquences néfastes graves pour la santé s'il était utilisé avec un niveau de probabilité raisonnable, elle a le pouvoir d'ordonner un rappel obligatoire si l'entreprise responsable n'en lance pas un volontairement (voir la section 611 pour plus de détails).
Tests d'amiante normalisés pour les produits contenant du talc - La FDA s'est engagée à fournir des méthodes de test d'amiante normalisées pour les produits contenant du talc dans un délai d'un an à compter de l'adoption du projet de loi (voir la section 3505 pour plus de détails).
Réévaluation de l'utilisation des PFA dans les produits cosmétiques - La FDA s'est engagée à réexaminer les risques liés à l'utilisation des perfluoroalkyles et des polyfluoroalkyles (PFA) dans les produits cosmétiques, en collaboration avec le National Center for Toxicological Research, et à fournir des orientations supplémentaires dans les trois ans suivant l'adoption du projet de loi (voir la section 3506 pour plus de détails).
Le projet de loi contient également des informations supplémentaires sur l'application, les sanctions et les préemptions, ainsi que des orientations générales sur les essais de produits sur les animaux. Veillez à ce qu'une personne qualifiée de votre organisation l'étudie attentivement afin de déterminer exactement l'impact de toutes ces dispositions sur votre entreprise.
Quand la MoCRA entre-t-elle en vigueur ?
Comme c'est souvent le cas pour les réformes réglementaires de grande ampleur, la FDA utilise une approche progressive pour la mise en œuvre afin que les entreprises de cosmétiques aient le temps de se préparer à répondre aux nouvelles exigences sans être immédiatement menacées de sanctions. Il convient de souligner à nouveau l'importance de se préparer maintenant, plutôt que plus tard, et nous avons quelques recommandations générales à cet égard.
À partir du 29 décembre 2023, toutes les entreprises concernées devront enregistrer leurs installations et soumettre des listes de produits contenant des informations détaillées. Votre entreprise peut commencer par rassembler les documents et les données nécessaires, et il est également judicieux de commencer à établir des justifications en matière de sécurité.
À partir du 29 décembre 2024, toutes les entreprises concernées devront divulguer la présence d'allergènes connus dans leurs produits et fournir les coordonnées de la personne responsable désignée. Pour l'instant, vous pouvez étudier les audiences de la FDA sur la divulgation des allergènes des parfums et évaluer les candidats à la fonction de personne responsable.
À partir du 29 décembre 2025, toutes les entreprises concernées devront fournir la preuve qu'elles respectent les bonnes pratiques de fabrication. L'examen de ces pratiques, ainsi que des audiences de la FDA qui s'y rapportent, devrait aider votre organisation à comprendre ce qui est nécessaire pour satisfaire à cette exigence.
Les mises à jour de la loi, y compris celles concernant les tests d'amiante et l'utilisation des PFA mentionnées ci-dessus, seront probablement diffusées au cours des mois et des années à venir. Dans le cadre de notre engagement envers l'industrie cosmétique et nos clients, nous couvrirons également les ajouts et les changements apportés à ces exigences au fil du temps.
L'importance de la transformation numérique pour la conformité réglementaire
Dans un avenir proche, nous fournirons du contenu supplémentaire pour explorer plus avant les implications du MoCRA, et nous expliquerons également comment les solutions de gestion du cycle de vie des produits cosmétiques (PLM), telles que notre propre Aptean PLM Lascom Edition, peuvent aider les entreprises de cosmétiques à se conformer aux nouvelles exigences.
Pour l'heure, nous souhaitons simplement vous faire part des raisons pour lesquelles la transformation numérique est importante pour toute entreprise confrontée à des problèmes de conformité. Avec un socle technologique cohérent et centralisé, votre entreprise peut atteindre le haut degré de disponibilité et d'accessibilité des données que requièrent les nouvelles normes exigeantes fixées par le MoCRA.
Votre organisation peut également fonctionner plus efficacement, en utilisant l'intégration avec l'équipement de fabrication et les lecteurs de codes-barres pour automatiser les processus manuels de collecte de données. Cela permet également de réduire le risque d'erreur humaine, car vos employés ne doivent plus griffonner sur du brouillon pour saisir les données dans le système.
De plus, les fonctions de gestion électronique des documents (GED) des logiciels PLM et d'autres systèmes d'entreprise peuvent faciliter la conservation et la localisation des enregistrements que la FDA peut demander, vous aidant ainsi à fournir rapidement la preuve de la conformité de vos produits et de vos opérations.
Aptean est votre partenaire idéal pour la transformation numérique. Nos professionnels dévoués ont une connaissance approfondie de l'industrie cosmétique, et nous adoptons une approche collaborative pour la mise en œuvre. Nous proposons également des déploiements flexibles dans le cloud de notre solution PLM et de nombreuses autres solutions de notre gamme complète de produits, vous offrant l'évolutivité, la protection des données et la cybersécurité renforcée dont vous avez besoin.
Enfin, The Software Report nous a classés à la 30e place de sa liste Power 500 Software Companies of 2023. Cela témoigne de la performance, de la fiabilité et de la qualité globale de nos solutions.
Si vous souhaitez en savoir plus sur Aptean PLM Lascom Edition ou toute autre solution logicielle du portefeuille d'Aptean, contactez-nous dès aujourd'hui. Vous pouvez également demander une démonstration personnalisée.
Discutez avec un expert de l’industrie cosmétique
Optimiser votre cycle de vie produit nécessite bien plus qu’un simple PLM. Il vous faut une solution conçue spécifiquement pour les complexités du secteur cosmétique, développée par des spécialistes qui comprennent vos défis quotidiens.